Azotyny

Multi tool use
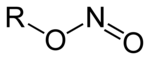
Ester azotynowy
Azotyny (nazwa Stocka: azotany(III)) – grupa związków chemicznych, soli lub estrów kwasu azotawego (azotowego(III)).
Spis treści
1 Budowa azotynów
2 Właściwości
3 Otrzymywanie
4 Ważniejsze azotyny
5 Zobacz też
6 Przypisy
Budowa azotynów |

Jon NO−2. Na obu atomach tlenu występują częściowe ładunki ujemne
Wszystkie azotyny zawierają jon NO−2. Jon ten jest izoelektronowy (ma tę samą liczbę elektronów i ich rozmieszczenie) z cząsteczką ozonu. Od anionu NO−3 występującego w azotanach różni się tym, że trzeci ze zhybrydyzowanych orbitali sp2 nie tworzy wiązania z atomem tlenu – zostaje zajęty przez niewiążącą parę elektronową. Obydwa wiązania N−O są równocenne, a cząsteczka ma kształt trójkąta równoramiennego. Budowę jonu azotynowego opisać też można za pomocą struktur rezonansowych:

W wyniku przyjęcia przez jon NO−2 kationu (np. wodoru czy metalu), na utworzenie wiązania jest zużywana jedna z niewiążących par elektronowych któregoś z atomów tlenu. W przypadku reakcji jonu NO−2 np. z atomem węgla powstają zarówno estry kwasu azotawego, jak i związki nitrowe.
Właściwości |
Nieorganiczne azotyny są substancjami krystalicznymi. Rozpuszczają się w wodzie. Mogą wykazywać zarówno właściwości redukujące, np. wobec nadmanganianu potasu w kwaśnym środowisku:
2KMnO4 + 5KNO2 + 3H2SO4 → 2MnSO4 + 5KNO3 + K2SO4 + 3H2O
czyli jonowo:
2MnO−4 + 5NO−2 + 6H+ → 2Mn2+ + 5NO−3 + 3H2O
jak i utleniające, np. wobec wodorków niemetali.
Azotyny nieorganiczne reagują w środowisku kwaśnym z pierwszorzędowymi aminami aromatycznymi. Reakcja ta nosi nazwę diazowania, a w jej wyniku powstają nietrwałe sole diazoniowe, które zwykle od razu poddaje się dalszym reakcjom, np.[1]:
Do wykrywania azotynów, można wykorzystać odczynnik Griessa. Metoda ta pozwala także na oznaczanie azotanów po ich wstępnej redukcji do azotynów[2].
Otrzymywanie |
Azotyny nieorganiczne można otrzymać przez wprowadzenie mieszaniny tlenku azotu i dwutlenku azotu do roztworów wodorotlenków lub węglanów metali alkalicznych, np.
- 2NaOH + NO + NO2 → 2NaNO2 + H2O
Inną metodą jest redukcja stopionych azotanów metalicznym ołowiem, np.
NaNO3 + Pb → NaNO2 + PbO
Niektóre azotany redukują się do azotynów w wyniku podgrzania, np.
2KNO3 → 2KNO2 + O2
Ważniejsze azotyny |
- azotyn potasu
- azotyn sodu
- azotyn amonu
- azotyn izoamylu
Zobacz też |
- obieg azotu w przyrodzie
Przypisy |
↑ R. V. Hoffman. m-Trifluoromethylbenzenesulfonyl Chloride. „Org. Synth.”. 60, s. 121, 1981. DOI: 10.15227/orgsyn.060.0121.
↑ Granger, Donald L., Taintor, Read R., Boockvar, Kenneth S., Hibbs Jr., John B. i inni. Measurement of nitrate and nitrite in biological samples using nitrate reductase and Griess reaction. „Methods in Enzymology”. 268, s. 142-151, 1996. DOI: 10.1016/S0076-6879(96)68016-1.
4omgmK
