Woda
| |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||
| Wzór sumaryczny | H2O | ||||||||||||||||||||||||||||||
| Inne wzory | HOH | ||||||||||||||||||||||||||||||
Masa molowa | 18,02 g/mol | ||||||||||||||||||||||||||||||
| Wygląd | lekko jasnoniebieska klarowna ciecz (w małych objętościach wydaje się bezbarwna) | ||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||
Numer CAS | 7732-18-5 | ||||||||||||||||||||||||||||||
PubChem | 962[1] | ||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||
| Inne aniony | kwasy protonowe (H+A−) | ||||||||||||||||||||||||||||||
| Inne kationy | wodorotlenki (B+OH−) | ||||||||||||||||||||||||||||||
| Podobne związki | amoniak siarkowodór, difluorek tlenu | ||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||

Woda na Ziemi. Kolor niebieski przedstawia oceany i morza otwarte, biały – morza zamknięte i jeziora, a szary – lądy

Chmury Cumulus humilis – skondensowana para wodna
Woda (tlenek wodoru; nazwa systematyczna IUPAC: oksydan) – związek chemiczny o wzorze H2O, występujący w warunkach standardowych w stanie ciekłym. W stanie gazowym wodę określa się mianem pary wodnej, a w stałym stanie skupienia – lodem. Słowo woda jako nazwa związku chemicznego może się odnosić do każdego stanu skupienia.
Woda jest bardzo dobrym rozpuszczalnikiem dla substancji polarnych. Większość występującej na Ziemi wody jest „słona” (około 97,38%), tzn. zawiera dużo rozpuszczonych soli, głównie chlorku sodu. W naturalnej wodzie rozpuszczone są gazy atmosferyczne, z których w największym stężeniu znajduje się dwutlenek węgla.
Woda naturalna w wielu przypadkach przed zastosowaniem musi zostać uzdatniona. Proces uzdatniania wody dotyczy zarówno wody pitnej, jak i przemysłowej.
Spis treści
1 Występowanie wody
1.1 Pochodzenie wody na Ziemi
1.2 Woda na innych ciałach niebieskich
2 Właściwości fizyczne wody
2.1 Aktywność promieniotwórcza wody
2.2 Kolor wody
3 Budowa i właściwości chemiczne
3.1 Autodysocjacja wody
4 Powstawanie w reakcjach chemicznych
5 Znaczenie biologiczne
6 Znaczenie kulturowe
7 Rozszerzalność temperaturowa
8 Zastosowanie wody
8.1 Rodzaje wody
8.1.1 Rodzaje wody w żywności
8.2 Zanieczyszczenia
8.3 Oczyszczanie
9 Zobacz też
10 Uwagi
11 Przypisy
12 Bibliografia
Występowanie wody |
Woda jest jedną z najpospolitszych substancji we Wszechświecie. Cząsteczka wody jest trzecią najbardziej rozpowszechnioną molekułą w ośrodku międzygwiazdowym, po cząsteczkowym wodorze i tlenku węgla[9]. Jest również szeroko rozpowszechniona w Układzie Słonecznym: stanowi istotny element budowy Ceres i księżyców lodowych krążących wokół planet-olbrzymów, jako domieszka występuje w ich atmosferach, a przypuszcza się, że duże jej ilości znajdują się we wnętrzach tych planet. Jako lód występuje także na części planetoid, a zapewne również na obiektach transneptunowych[10].
Woda jest bardzo rozpowszechniona także na powierzchni Ziemi. Występuje głównie w oceanach, które pokrywają 70,8% powierzchni globu, ale także w rzekach, jeziorach i w postaci stałej w lodowcach. Część wody znajduje się w atmosferze (chmury, para wodna). Niektóre związki chemiczne zawierają cząsteczki wody w swojej budowie (hydraty – określa się ją wówczas mianem wody krystalizacyjnej). Zawartość wody włączonej w strukturę minerałów w płaszczu Ziemi może przekraczać łączną zawartość wody w oceanach i innych zbiornikach powierzchniowych nawet dziesięciokrotnie[11].
Woda występująca w przyrodzie jest roztworem soli i gazów. Najwięcej soli mineralnych zawiera woda morska i wody mineralne; najmniej woda z opadów atmosferycznych. Wodę o małej zawartości składników mineralnych nazywamy wodą miękką, natomiast zawierającą znaczne ilości soli wapnia i magnezu – wodą twardą. Oprócz tego wody naturalne zawierają rozpuszczone substancje pochodzenia organicznego, np. mocznik, kwasy humusowe itp.
Pochodzenie wody na Ziemi |
Zagadnienie pochodzenia wody na Ziemi, jak i tego, że na Ziemi jest znacznie więcej wody niż na innych skalistych planetach Układu Słonecznego, jest wciąż niejasne. Istnieje kilka hipotez co do tego, w jaki sposób woda mogła zebrać się na powierzchni Ziemi w ilości wystarczającej do wytworzenia oceanów. Główna hipoteza głosi, że woda w stanie wolnym lub w związkach chemicznych była obecna na Ziemi w trakcie formowania się Ziemi. Przy weryfikowaniu hipotez dotyczących pochodzenia wody uwzględnia się skład izotopowy wodoru z różnych źródeł. Badania składu izotopowego wodoru uwięzionego w najstarszych skałach znalezionych na Ziemi wykazują zgodność składu izotopowego z wodą oceaniczną[12]. Ważniejszymi innymi hipotezami są:
hipoteza solarna – wiatr słoneczny niesie za sobą jądra (atomy) wodoru, które wchodzą w reakcję z tlenem tworząc cząsteczki wody- uderzenia asteroid – Ziemia ukształtowała się wewnątrz linii śniegu, teorie zakładają, że lekkie pierwiastki i związki chemiczne, w tym i woda, powinny być wymiecione przez promieniowanie tworzącej się gwiazdy. Wodę na Ziemię miałyby przynieść duże obiekty z zewnętrznego Układu Słonecznego (spoza linii śniegu), uderzające w naszą planetę w początkach jej istnienia[13].
hipoteza geochemiczna – zakłada powstawanie wody na skutek reakcji chemicznych w płaszczu Ziemi. Dwutlenek krzemu może tam reagować z wodorem, w efekcie czego powstaje ciekła woda i wodorek krzemu, SiH
4. Proces zachodzi przy ciśnieniu sięgającym 200 tys. atm. Woda pozostaje uwięziona w skale i z czasem wydostaje się na powierzchnię, między innymi podczas erupcji wulkanów[14].
Woda na innych ciałach niebieskich |
Obecność wody (w postaci lodu) na Księżycu w głębi zacienionego krateru została wykazana podczas misji LCROSS 8 października 2009 r. NASA odkryła wodę na Marsie przez bezpośrednią obserwację 31 lipca 2008 roku[15], a analizy jego atmosfery wskazują, że Mars utracił w geologicznej historii ilość wody wystarczającą do utworzenia oceanu. Znaczące ilości wody stwierdzono m.in. w pierścieniach Saturna oraz na księżycach lodowych. Pięć z nich posiada oceany podpowierzchniowe, niektóre zamknięte między warstwami lodu o różnej strukturze, a niektóre w kontakcie ze skalistym wnętrzem, co daje szanse na aktywność hydrotermalną i potencjał do rozwinięcia się życia. W szczególności ocean na Enceladusie, księżycu Saturna, ma bezpośredni kontakt z powierzchnią poprzez aktywność gejzerów[10].
Właściwości fizyczne wody |

Diagram fazowy wody

Czterotonowa bryła lodu na plaży w Islandii – woda w stanie stałym

Moneta utrzymująca się na powierzchni wody dzięki napięciu powierzchniowemu

Rozkład ładunku dookoła cząsteczki wody: kolor czerwony – cząstkowy ładunek ujemny, kolor niebieski – cząstkowy ładunek dodatni
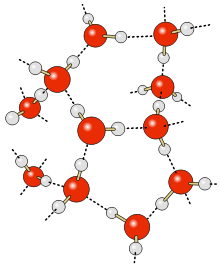
Łączenie się cząsteczek wody. Ciągłe – wiązania atomowe, przerywane – wiązania wodorowe.
temperatura topnienia pod ciśnieniem 1 atm: 0 °C = 273,152519 K
temperatura wrzenia pod ciśnieniem 1 atm: 99,97 °C = 373,12 K
punkt potrójny: 0,01 °C = 273,16 K, 611,657 Pa
gęstość w temperaturze 3,98 °C: 1 kg/l (gęstość maksymalna)[a]
temperatura krytyczna: 647,096 K[17] (ok. 374 °C)
ciśnienie krytyczne: 22,064 MPa[17]
ciepło właściwe: 4187 J/(kg·K) = 1 kcal/(kg·K)
ciepło parowania: 2257 kJ/kg
ciepło topnienia: 333,7 kJ/kg
masa cząsteczkowa: 18,01524 Da
względna przenikalność elektryczna w stałym polu elektrycznym: 87,9 (0 °C), 78,4 (25 °C), 55,6 (100 °C)
napięcie powierzchniowe: 72,4·10−3N/m (18 °C)[18].
barwa: lekko jasnoniebieska (w małych objętościach wydaje się bezbarwna)[19][20]
zapach: bezwonna
konduktywność, σ, lub rezystywność, ρ: dla dobrej jakości wody destylowanej lub demineralizowanej ρ > 18 MΩm
odczyn: 7,0
Dla wody zawierającej inne substancje określa się szereg dodatkowych właściwości, np.
- barwa wody
mętność/ilość zawiesin w wodzie (woda chemicznie czysta: klarowna)
twardość (woda chemicznie czysta: 0)
- twardość ogólna
twardość węglanowa (przemijająca)
twardość niewęglanowa (trwała)
utlenialność (woda chemicznie czysta: 0)
Aktywność promieniotwórcza wody |
Aktywność wody pitnej nie powinna przekraczać 0,5 Bq/l w przypadku promieniowania alfa i 1 Bq/l w przypadku promieniowania beta. Taki poziom aktywność powinien skutkować roczną dawką na poziomie ok. 1 mSv lub mniejszym. Powyżej tych poziomów WHO zaleca dokładniejsze określenie, który izotop odpowiada na podwyższoną aktywność i porównanie aktywności z wartościami sugerowanymi. Przy dawkach >1mSv/rok zaleca się rozważanie oczyszczenia wody w celu zmniejszenia jej aktywności[21].
Za aktywność własną wody odpowiada przede wszystkim aktywność izotopów tlenu[21].
Kolor wody |
Lekko niebieski kolor wody wynika z pochłaniania przez nią promieniowania elektromagnetycznego z zakresu światła widzialnego odpowiadającego barwie czerwonej (światło czerwone jest absorbowane przez wodę ok. 100 razy silniej niż niebieskie[22]). Maksimum silnej absorpcji przypada na 760 nm i ramię tego pasma wchodzi częściowo w zakres widzialny (<700 nm). Obecne są też dwa słabe maksima przy 605 i 660 nm. Pochłaniane promieniowanie powoduje przejścia pomiędzy poziomami oscylacyjnymi, a w efekcie silnie wzbudzone drgania atomów cząsteczek wody. Zachodzenie pasm absorpcji oscylacyjnej na zakres widzialny jest unikalną cechą wody i stanowić może jedyny przypadek takiego źródła barwy substancji. Pozostałe barwne cząsteczki i atomy zawdzięczają swój kolor absorpcji światła widzialnego przez elektrony[19] (barwa może być też wynikiem zjawisk optycznych).
W stanie gazowym pasma absorpcji wody przesunięte są w kierunku światła widzialnego (wyższej częstotliwości), a w stanie stałym w kierunku podczerwieni (niższej częstotliwości), co wynika odpowiednio z osłabienia i wzmocnienia oddziaływań wodorowych. Lód wykazuje także barwę niebieską w świetle przechodzącym, a jego widmo IR jest zbliżone do widma wody ciekłej. Światło przechodzące przez śnieg ma szczególnie intensywnie niebieską barwę w wyniku wielokrotnego rozproszenia[19].
W ciężkiej wodzie (D2O) drgania oscylacyjne przesunięte są znacząco w kierunku podczerwieni (pasmo 760 nm wody znajduje się przy ok. 1000 nm), w wyniku czego ciężka woda jest bezbarwna. Zjawisko to jest jednym z dowodów na poprawność przypisania barwy wody absorpcji oscylacyjnej[19].
Budowa i właściwości chemiczne |
Cząsteczki wody są nieliniowe, a wiązania H–O są silnie spolaryzowane i stąd woda ma trwały moment dipolowy – czyli jest silnie polarna. Kąt między wiązaniami wodór-tlen-wodór (H―O―H) w fazie ciekłej wynosi ok. 105°. W postaci stałej (lodu) kąt między tymi wiązaniami jest równy ok. 108°.
Woda jest najtrwalszym tlenkiem w grupie tlenowców. Jej dysocjacja termiczna
- H2O ⇌ H2 + ½O2 ΔE 285,8 kJ/mol
staje się znacząca dopiero w temperaturze kilku tysięcy stopni Celsjusza. Np. w 3200 °C zdysocjowane na pierwiastki jest ok. 30% cząsteczek H2O (dla porównania siarkowodór w temperaturze 1700 °C jest zdysocjowany w ok. 75%)[23].
W fazie ciekłej nieustannie powstają i pękają wiązania wodorowe pomiędzy cząsteczkami wody. Woda ulega łatwej protonacji i deprotonacji od kwasów tworząc jon hydroniowy H3O+. Jon ten również łączy się wiązaniami wodorowymi tworząc kation Zundela H5O2+, kation Eigena H9O4+ i większe aglomeraty.
W strukturze krystalicznej wiązania wodorowe nie ulegają zrywaniu i determinują heksagonalny układ krystalograficzny wody.
Gdy podda się wodę ciśnieniu większemu niż 3900 MPa, woda zwiększa gęstość do około 1,5 g/cm³ i powstaje lód o temperaturze powyżej 0 °C.

Fala na wodzie po upadku kropli
Autodysocjacja wody |
W fazie ciekłej woda ulega samoistnej jonizacji zwanej autodysocjacją zgodnie z reakcją:
- H2O + H2O ⇌ H3O+ + OH−,
tworząc kation, jon hydroniowy i anion, jon wodorotlenowy.
Równowagę autodysocjacji wody opisuje tzw. iloczyn jonowy wody, który w temperaturze 20 °C jest równy ok. 10−14 (zwykle wielkość bezwymiarowa lub mol²/kg²) (zobacz skala pH).
Powstawanie w reakcjach chemicznych |
Woda jest produktem ubocznym wielu reakcji chemicznych, np.
spalanie wodoru i związków organicznych w obecności tlenu, np.
- 2H2 + O2 → 2H2O
- C2H5OH + 3O2 → 2CO2 + 3H2O
reakcje zobojętniania, np.
- NaOH + HCl → NaCl + H2O
- Ca(OH)2 + CO2 → CaCO3↓ + H2O
- K2O + H2SO4 → K2SO4 + H2O
redukcja wodorem związków chemicznych zawierających tlen, np.
- Na2SO4 + 4H2 → Na2S + 4H2O
- niektóre reakcje kondensacji, np.
- C2H5OH + HCOOH → HCOOC2H5 + H2O.
Znaczenie biologiczne |
Woda jest powszechnym rozpuszczalnikiem związków ustrojowych i niezbędnym uzupełnieniem pokarmu wszystkich znanych organizmów. Uczestniczy w przebiegu większości reakcji metabolicznych, stanowi środek transportu wewnątrzustrojowego, np. produktów przemiany materii, substancji odżywczych, hormonów, enzymów. Reguluje temperaturę. Stanowi płynne środowisko niezbędne do usuwania końcowych produktów przemiany materii. Woda stanowi średnio 70% masy dorosłego człowieka, w przypadku noworodka ok. 15% więcej, 60–70% limfy, 95% osocza krwi, 90% liści, owoców, 20% kości, 10% szkliwa zębów, tkanki tłuszczowej.
W roku 2008 na świecie ok. 1,1 mld ludzi nie miało bezpośredniego dostępu do wody pitnej[24]. Każdego dnia choroby wynikające z niedostatku czystej wody powodują śmierć wielu tysięcy ludzi, głównie dzieci.
Znaczenie kulturowe |
W przednaukowej filozofii przyrody woda była jedną z podstaw rzeczywistości materialnej. Tales z Miletu widział w niej Arché: podstawową zasadę[25]. Dla Empedoklesa i Arystotelesa woda była jednym z czterech klasycznych żywiołów, które przez wzajemne połączenia tworzyły rzeczywistość[26]. Była też jednym z pięciu żywiołów w tradycji chińskiej i japońskiej.
Symbolizuje życie, płodność i oczyszczenie (choć bywa także ukazywana jako siła zła, zwłaszcza w przeciwstawieniu wody czystej i brudnej). Woda jest częstym elementem mitów kosmogonicznych. Bywa też uważana za medium ułatwiające przejście z jednego świata do drugiego (w mitologii greckiej Charon przewoził łodzią duszę zmarłego do Hadesu, gdzie pijąc wodę ze źródła Lete zapominała o minionej egzystencji)[27]. W wielu religiach zanurzenie w wodzie symbolizuje oczyszczenie i odrodzenie (por. chrzest).
Od 1992 r. 22 marca obchodzony jest Światowy Dzień Wody.
Rozszerzalność temperaturowa |
Gęstość wody w funkcji temperatury[28][29] | |
|---|---|
| temp. [°C] | gęstość [kg/m³] |
| 100 | 958,4 |
| 80 | 971,8 |
| 60 | 983,2 |
| 40 | 992,2 |
| 30 | 995,7 |
| 25 | 997,0 |
| 20 | 998,2 |
| 15 | 999,1 |
| 10 | 999,7 |
| 4,0 | 999,9720 |
| 0 | 999,8 |
| −10 | 998,2 |
| −20 | 993,5 |
| −30 | 983,9 |
| Dane dla temperatur poniżej 0 °C dot. wody przechłodzonej[30] | |
Woda, jako jedna z niewielu substancji, nie zwiększa swojej objętości monotonicznie ze wzrostem temperatury w całym obszarze występowania w stanie ciekłym, lecz przyjmuje wartość minimalną dla 3,98 °C. W temperaturach niższych od tej wartości objętość wody zwiększa się wraz ze spadkiem temperatury, co wśród ogółu substancji chemicznych jest anomalią. Zjawisko to spowodowane jest specyficznym kształtem cząsteczki wody oraz istnieniem silnych wiązań wodorowych. Wiązania te nadają wodzie względnie dużą gęstość, a ponadto pękają w obszarze anomalnym, zwiększając nieuporządkowanie wśród cząsteczek, a co za tym idzie, zwiększając również objętość cieczy. Z tego samego powodu objętość wody wzrasta również podczas krzepnięcia – dlatego lód pływa po powierzchni wody, rozsadza naczynia, kruszy spękane skały, niszczy nawierzchnię dróg itp.
Zastosowanie wody |
Jako substancja użytkowa woda ma wiele zastosowań. Najważniejsza jest woda pitna, w gospodarstwach domowych jest używana woda do celów sanitarno-bytowych, w rolnictwie zaś do nawadniania pól. Znaczne ilości wody zużywają zakłady przemysłowe. Woda przemysłowa może służyć jako substancja będąca przekaźnikiem ciepła, magazynująca ciepło lub je odbierająca (substancja chłodząca), poza tym jako reagent, rozpuszczalnik itp.
Woda jest powszechnym i zwykle łatwo dostępnym środkiem gaśniczym. Jej działanie polega głównie na absorpcji ciepła z gaszonego materiału. Dodatkowo para wodna powstająca podczas parowania wody utrudnia dostęp tlenu niezbędnego do podtrzymania dalszego procesu palenia[31].

20% światowych zasobów wody słodkiej (23 000 km³) jest zgromadzone w jeziorze Bajkał

Woda w fontannie
Rodzaje wody |
Rodzaje wody w zależności od czystości i zastosowania (w przybliżeniu w kolejności procesu produkcyjnego):
woda surowa
woda opadowa, np. deszczówka
woda powierzchniowa, np. rzeka
woda podziemna
- woda podskórna
- woda gruntowa
- woda wgłębna
- woda głębinowa
- woda źródlana
- woda mineralna
woda słona, np. morska
woda słodka, np. z jeziora
woda użytkowa (zasoby wodne)
- woda wodociągowa
- woda pitna
woda przemysłowa
przygotowanie wody
- woda twarda
- woda miękka
- woda demineralizowana
- woda gorzka
- woda odgazowana
- woda zasilająca
- woda kotłowa
- woda obiegowa
skropliny (kondensat)
- woda destylowana
woda podwójnie destylowana (woda redestylowana)
ścieki
- ścieki komunalne
- ścieki bytowe
- ścieki przemysłowe
- woda zęzowa
- fekalia
- gnojowica
- mocz
Rodzaje wody w żywności |
- woda wolna (niezwiązana): ok. 5–100%
- rozpuszczalnik substancji organicznych i związków mineralnych; łatwo wydziela się z produktu pod wpływem czynników zewnętrznych; ma właściwości zbliżone do właściwości wody w rozcieńczonych roztworach soli; powiązana siecią wzajemnych wiązań wodorowych.
- woda związana (zlokalizowana w bezpośrednim sąsiedztwie substancji rozpuszczonych):
- woda strukturalna (<0,03%)
- jest integralną częścią składników niewodnych; ulokowana w wolnych przestrzeniach makrocząsteczek lub związana w postaci wodzianów.
- woda związana w postaci monowarstwy (0,1–0,9%)
- silnie oddziałuje z grupami polarnymi i zjonizowanymi składników niewodnych
- woda uwięziona (ok. 5–96%)
- o właściwościach wody wolnej, ale uwięziona w niewypełnionych przestrzeniach składników strukturalnych lub w żelach, przez co jej przepływ jest utrudniony[potrzebny przypis].
Zanieczyszczenia |
- typ:
- mechaniczne, np. muł
- koloidalne, np. olej
- roztwory, np. sól
- biologiczne, np. bakterie (miano Coli), wirusy
- mechaniczne, np. muł
Klasyfikacja zanieczyszczeń ze względu na:
- sposób ich usuwania:
- zanieczyszczenia zawieszone i pływające; usuwane w procesach fizycznych sedymentacji lub filtracji
- zanieczyszczenia koloidalne – o cząsteczkach wielkości poniżej 100 μm; usuwane w specjalnych procesach, np. ultrafiltracji, koagulacji
- zanieczyszczenia rozpuszczone – w formie roztworu; usuwane metodami fizykochemicznymi lub metodami chemicznymi.
- zanieczyszczenia zawieszone i pływające; usuwane w procesach fizycznych sedymentacji lub filtracji
- wpływ na zdrowie:
- związki trujące i szkodliwe
- związki nieszkodliwe – w zależności od stężenia mogą równocześnie wskazywać na zanieczyszczenie wody
- związki pożądane dla zdrowia.
- ich pochodzenie:
- biologiczne i bakteriologiczne
- fizyczne
- chemiczne
- izotopami pierwiastków promieniotwórczych.
Oczyszczanie |

Woda pokrywa 71% powierzchni Ziemi
biologiczne:
- bakterie
- inne mikroorganizmy
chemiczne:
- ozonowanie wody
- strącanie osadów
- wymiana jonowa
- chlorowanie
mechaniczne:
- destylacja
- filtracja
- odwrócona osmoza
- sedymentacja
- krystalizacja
Zobacz też |
- monotlenek diwodoru
- wirtualna woda
Woda – wielka tajemnica – film dokumentalny o strukturze wody- Woda (album)
Roztwory wodne:
- woda wapienna
- woda królewska
- woda amoniakalna
- woda utleniona
- woda pogazowa
woda kwiatowa, woda kolońska
woda sodowa, woda mineralna, woda stołowa
Uwagi |
↑ Gęstość wody pod normalnym ciśnieniem atmosferycznym w zależności od temperatury opisuje wzór[16]:
- q=1000/[4,074⋅10−6(t−4)2−0,0104πcos(π(t−4)/104)+1,0033][kg/m3]{displaystyle q=1000/[4,074cdot 10^{-6}(t-4)^{2}-{frac {0{,}0104}{pi }}cos {(pi (t-4)/104)}+1{,}0033][kg/m^{3}]}
- gdzie t – temperatura w °C
- q=1000/[4,074⋅10−6(t−4)2−0,0104πcos(π(t−4)/104)+1,0033][kg/m3]{displaystyle q=1000/[4,074cdot 10^{-6}(t-4)^{2}-{frac {0{,}0104}{pi }}cos {(pi (t-4)/104)}+1{,}0033][kg/m^{3}]}
Przypisy |
↑ Woda (CID: 962) (ang.) w bazie PubChem, United States National Library of Medicine.
↑ abcd Lide 2009 ↓, s. 4–98.
↑ ab Lide 2009 ↓, s. 6–53.
↑ Lide 2009 ↓, s. 6–175.
↑ Lide 2009 ↓, s. 6–127.
↑ Lide 2009 ↓, s. 9–52.
↑ ab Woda (ZVG: 1140) (ang. • niem.) w bazie GESTIS, Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA). [dostęp 2011-05-05].
↑ Woda (nr 12156) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Stanów Zjednoczonych. [dostęp 2011-05-05].
↑ Sun Kwok: Physics And Chemistry of the Interstellar Medium. University Science Books, 2007. ISBN 1-891389-46-7.
↑ ab Preston Dyches, Felicia Chou: The Solar System and Beyond is Awash in Water (ang.). NASA / Jet Propulsion Laboratory, 2015-04-07. [dostęp 2015-04-10]. [zarchiwizowane z tego adresu (2015-04-10)].
↑ Ben Harder: Inner Earth May Hold More Water Than the Seas (ang.). National Geographic News, 2002-03-07. [dostęp 2013-02-17].
↑ Nowe fakty na temat pochodzenia wody na Ziemi. [dostęp 2017-02-17].
↑ Głos sondy Rosetta w dyskusji o pochodzeniu wody na Ziemi. [dostęp 2017-02-17].
↑ Planet Earth makes its own water from scratch deep in the mantle, „New Scientist” [dostęp 2017-02-17] (ang.).
↑ Sonda Phoenix potwierdza istnienie wody na Marsie.
↑ Krystyna Jeżowiecka-Kabsch, Henryk Szewczyk: Mechanika płynów. Wrocław: Oficyna Wydawnicza Politechniki Wrocławskiej, 2001, s. 358.
↑ ab „Guideline on the Use of Fundamental Physical Constants and Basic Constants of Water”, The International Association for the Properties of Water and Steam, Gaithersburg, Maryland, USA, September 2001, (pdf).
↑ Laboratorium z chemii fizycznej. Wydział Inżynierii Materiałowej i Ceramiki AGH. [dostęp 2012-11-06].
↑ abcd Charles L. Braun, Sergei N. Smirnov. Why is water blue?. „Journal of Chemical Education”. 70 (8), s. 612–614, 1993. DOI: 10.1021/ed070p612 (ang.).
↑ Robert L. Wolke: Co Einstein powiedział swojemu fryzjerowi. Klub Dla Ciebie, 2002. ISBN 83-88729-93-4.
↑ ab red. nacz. tomu Jan Zienkiewicz: red. nacz. Heliodor Chmielewski: Encyklopedia Techniki. T. Energia jądrowa. Warszawa: Wydawnictwa Naukowo-Techniczne, 1970, s. 16, seria: Encyklopedia Techniki.
↑ Martin Chaplin: Water Absorption Spectrum. 2011-11-15 (data ostatniej aktualizacji). [dostęp 2012-03-20].
↑ Adam Bielański: Podstawy chemii nieorganicznej. Wyd. 5. Warszawa: PWN, 2002, s. 601–602. ISBN 83-01-13654-5.
↑ M. Barry, J.M. Hughes. Talking dirty--the politics of clean water and sanitation. „N Engl J Med”. 359 (8), s. 784–787, 2008. DOI: 10.1056/NEJMp0804650. PMID: 18716296.
↑ Reale 1994 ↓, s. 75–102.
↑ Reale 1994 ↓, s. 172.
↑ Vojtech Zamarovský: Bohovia a hrdinovia antických bájí. Bratislava: Perfekt a.s., 1998, s. 258–259. ISBN 80-8046-098-1. (słow.); polskie wydanie: Bogowie i herosi mitologii greckiej i rzymskiej (Encyklopedia mitologii antycznej, Słownik mitologii greckiej i rzymskiej).
↑ CRC Handbook of Chemistry and Physics. Wyd. 88. Boca Raton: CRC Press, 2008, s. 6-4, 6-5.
↑ Gęstość wody dla temperatur 0...40 °C. [dostęp 2014-02-23]. (dane za Bigg, PH. Density of water in SI units over range 0-40 degrees C. „British Journal of Applied Physics”. 18 (4), s. 521-&, 1967. DOI: 10.1088/0508-3443/18/4/315. ).
↑ CRC Handbook of Chemistry and Physics. Wyd. 88. Boca Raton: CRC Press, 2008, s. 6-194.
↑ Środki gaśnicze i podręczny sprzęt gaśniczy. Ochotnicza Straż Pożarna w Trześni. [dostęp 2012-11-06].
Bibliografia |
- CRC Handbook of Chemistry and Physics, David R.D.R. Lide (red.), wyd. 90, Boca Raton: CRC Press, 2009, ISBN 978-1-4200-9084-0 .
- Giovanni Reale: Historia filozofii starożytnej. T. 1. Lublin: Wydawnictwo KUL, 1994.
- M. Overman Woda, PWN, Warszawa 1977.
- M.L. Biełaja Teoria wody – od wieku XVIII do dziś w: Problemy nr 5/1989.
- E. Grochowicz, J. Korytkowski Ochrona przyrody i wód cz. 1, WSiP, Warszawa 1996, ISBN 83-02-06010-0.
Kontrola autorytatywna (związek chemiczny):
LCCN: sh85145447
GND: 4064689-0
NDL: 00567741
BnF: 11931913j
BNCF: 6045
- WorldCat


![{displaystyle q=1000/[4,074cdot 10^{-6}(t-4)^{2}-{frac {0{,}0104}{pi }}cos {(pi (t-4)/104)}+1{,}0033][kg/m^{3}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/db53d3fac144807032bd5188ced6cc17a7cbfae8)