Chlorek glinu
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
![Próbki AlCl3·6H2O ([Al(H2O)6]Cl3)](http://upload.wikimedia.org/wikipedia/commons/thumb/f/f6/Aluminium-trichloride-hexahydrate-white-and-yellow.jpg/162px-Aluminium-trichloride-hexahydrate-white-and-yellow.jpg) Próbki AlCl3·6H2O ([Al(H2O)6]Cl3) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | AlCl3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
Masa molowa | 133,34 g/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd | białe lub żółte ciało stałe | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | ||||||||||||||||||||||||||||||||||||||||||||||||||||
Numer CAS | 7446-70-0 7784-13-6 (heksahydrat) | |||||||||||||||||||||||||||||||||||||||||||||||||||
PubChem | 24012[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inne aniony | trichlorek boru chlorek magnezu chlorek indu(III) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Inne kationy | fluorek glinu bromek glinu jodek glinu | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | chlorek żelaza(III), fluorek boru | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klasyfikacja medyczna | ||||||||||||||||||||||||||||||||||||||||||||||||||||
ATC | D10 AX01 | |||||||||||||||||||||||||||||||||||||||||||||||||||
Chlorek glinu, AlCl3 – nieorganiczny związek chemiczny, sól kwasu solnego i glinu. Jest białym ciałem stałym[8] (produkty handlowe mogą mieć zabarwienie żółte[3]). Związek bezwodny dymi na powietrzu z powodu hydrolizy spowodowanej parą wodną. Jest kwasem Lewisa i stosowany jest głównie jako katalizator w reakcji Friedla-Craftsa[5].
Spis treści
1 Struktura
2 Otrzymywanie
3 Właściwości fizyczne
4 Właściwości chemiczne
5 Zastosowanie
6 Przypisy
Struktura |
W stanie stałym chlorek glinu ma budowę krystaliczną o strukturze warstwowej, w której glin ma liczbę koordynacyjną 6[5]. W stanie ciekłym i gazowym (poniżej 400 °C) jest dimerem, Al2Cl6, zaś w wysokiej temperaturze przyjmuje formę monomeru, AlCl3 (forma wyłączna powyżej 800 °C)[4].
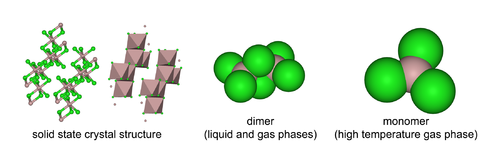
Trójwymiarowe struktury chlorku glinu
Heksahydrat ma charakter soli kompleksowej [Al(H2O)6]Cl3[9].
Otrzymywanie |
Bezwodny chlorek glinu otrzymuje się m.in. w reakcji glinu z chlorem lub chlorowodorem[10]:
- 2Al + 3Cl2 → 2AlCl3 (podstawowa metoda przemysłowa)[4]
- 2Al + 6HCl → 2AlCl3 + 3H2
Inną metodą przemysłową jest chlorowanie tlenku glinu mieszaniną chloru i tlenku węgla[4].
Heksahydrat można uzyskać rozpuszczając tlenek glinu w kwasie solnym, a w formie krystalicznej – przepuszczając HCl przez nasycony roztwór związku[4].
Właściwości fizyczne |
Chlorek glinu przy ogrzewaniu pod normalnym ciśnieniem sublimuje przy 180 °C. Pod zwiększonym ciśnieniem topi się w temperaturze ok. 192 °C, czemu towarzyszy gwałtowny spadek przewodnictwa elektrycznego i wzrost objętości o 85%. Wynika to ze zmiany struktury podczas przemiany fazowej[5][9].
Właściwości chemiczne |
Chlorek glinu reaguje bardzo gwałtownie z wodą tworząc heksahydrat, AlCl3·6H2O, hydrolizujący do tlenochlorku glinu, AlClO, i kwasu solnego, w wyniku czego roztwór ma charakter silnie kwasowy[4]. Ogrzewanie heksahydratu prowadzi do wydzielenia chlorowodoru, pary wodnej i tlenku glinu (Al2O3)[10].
Zastosowanie |
Chlorek glinu stosuje się jako katalizator w syntezie organicznej (np. w reakcji Friedla-Craftsa)[10]:
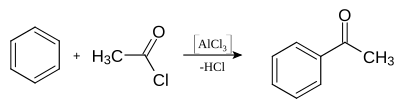
Reakcja Friedla-Craftsa z udziałem chlorku glinu jako katalizatora
Jest on również stosowany do wyrobu papieru pergaminowego, a także w garbarstwie i medycynie[10].
Przypisy |
↑ Chlorek glinu (CID: 24012) (ang.) w bazie PubChem, United States National Library of Medicine.
↑ ab Chlorek glinowy w katalogu Merck Chemicals (pol.). [dostęp 2011-03-07].
↑ ab Chlorek glinu (nr 563919) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Polski.
↑ abcdef Otto Helmboldt, L. Keith Hudson, Chanakya Misra, Karl Wefers, Wolfgang Heck, Hans Stark, Max Danner, Norbert Rösch. Aluminum Compounds, Inorganic. „Ullmann's Encyclopedia of Industrial Chemistry”, 2007. DOI: 527.pub2 10.1002/14356007.a01 527.pub2.
↑ abcd N. N. Greenwood, A. Earnshaw: Chemistry of the elements. Oxford; New York: Pergamon Press, 1984, s. 262-266. ISBN 0-08-022057-6.
↑ ab Chlorek glinu (ang.) w wykazie klasyfikacji i oznakowania Europejskiej Agencji Chemikaliów. [dostęp 2015-04-10].
↑ Chlorek glinu (ang.). [martwy link] The Chemical Database. The Department of Chemistry, University of Akron. [dostęp 2012-06-24].
↑ Dale L. Perry: Handbook of inorganic compound. Boca Raton: Taylor Francis, 2011, s. 5. ISBN 978-1-4398-1461-1.
↑ ab Adam Bielański: Podstawy chemii nieorganicznej. Wyd. 5. Warszawa: PWN, 2002, s. 789. ISBN 83-01-13654-5.
↑ abcd Podręczny słownik chemiczny, RomualdR. Hassa (red.), JanuszJ. Mrzigod (red.), JanuszJ. Nowakowski (red.), Katowice: Videograf II, 2004, s. 72, ISBN 83-7183-240-0 .
| ||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
![]() Zapoznaj się z zastrzeżeniami dotyczącymi pojęć medycznych i pokrewnych w Wikipedii.
Zapoznaj się z zastrzeżeniami dotyczącymi pojęć medycznych i pokrewnych w Wikipedii.


