Punkt krytyczny (fizyka)
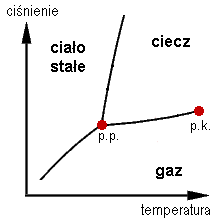
Punkt krytyczny (p.k.) na wykresie równowagi faz dla czystej substancji
Punkt krytyczny, warunki krytyczne – punkt przejścia układu fizycznego w stan o odmiennych właściwościach (ciecz nasycona–para nasycona), w którym nie można rozróżnić obu stanów. Na przykład:
- dla czystych substancji punkt krytyczny oznacza temperaturę krytyczną (i odpowiadające mu ciśnienie krytyczne, czyli maksymalne ciśnienie nad daną cieczą), powyżej której nie można skroplić gazu niezależnie od wielkości ciśnienia. Jest to punkt krytyczny dwuwymiarowy (układ o dwóch stopniach swobody – 2D). Parametry krytyczne oznacza się często dolnymi indeksami „kr”, „k”, „cr” lub „c”, czasami z dodatkiem „2D” („2”), „3D” („3”) itd., w zależności od tego, jakiego układu dotyczą, na przykład T3c. Dla gazów parametry krytyczne można określić na podstawie współczynników odpowiedniego równania stanu, na przykład równania van der Waalsa.
- w przypadku gazów zaadsorbowanych na powierzchni (układ dwuwymiarowy), jak i innych zjawisk związanych z dwoma wymiarami (2D), warunki krytyczne będą się różniły. Wiele przejść fazowych również zachodzi jedynie w warunkach powyżej lub poniżej pewnych wartości krytycznych (gęstości, temperatury, ciśnienia).
- punkt krytyczny dla ciekłych układów wieloskładnikowych oznacza stan, w którym zanika różnica między współistniejącymi fazami ciekłymi – dla wielu mieszanin ciekłych istnieją obszary (określone przede wszystkim przez temperatury krytyczne), w których istnieje całkowita mieszalność, i obszary, gdzie istnieje ograniczenie rozpuszczalności, a więc w pewnym zakresie stężeń współistnieją (zwykle dwie) odrębne fazy (np. faza A nasycona składnikiem B oraz faza B nasycona składnikiem A).
Spis treści
1 Stałe krytyczne
1.1 Gaz van der Waalsa
1.2 Ciecze o ograniczonej mieszalności
2 Zredukowane stałe krytyczne
3 Zobacz też
4 Uwagi
5 Bibliografia
Stałe krytyczne |
Gaz van der Waalsa |
Dla gazu, którego stan może być opisany za pomocą równania van der Waalsa, parametry krytyczne, zwane też stałymi krytycznymi, wyraża się poprzez parametry tego równania:
- temperatura krytyczna – Tk=8a27bR{displaystyle T_{k}={frac {8a}{27bR}}}
- ciśnienie krytyczne – pk=a27b2{displaystyle p_{k}={frac {a}{27b^{2}}}}
- molowa objętość krytyczna – Vk=3b{displaystyle V_{k}=3b}
gdzie:
R{displaystyle R}– (uniwersalna) stała gazowa
T{displaystyle T}– temperatura
a,b{displaystyle a,b}– parametry równania van der Waalsa:
- (p+aV2)(V−b)=RT{displaystyle left(p+{frac {a}{V^{2}}}right)(V-b)=RT}
- gdzie:
p{displaystyle p}– ciśnienie
V{displaystyle V}– objętość molowa[a]
- (p+aV2)(V−b)=RT{displaystyle left(p+{frac {a}{V^{2}}}right)(V-b)=RT}
Ciecze o ograniczonej mieszalności |
Warunki krytyczne dla cieczy o ograniczonej mieszalności określają temperatury:
górna temperatura krytyczna – jeżeli istnieje temperatura, powyżej której ciecze stają się całkowicie mieszalne, poniżej tej temperatury wzajemna rozpuszczalność jest ograniczona (w pewnym przedziale składów wyjściowych uzyskujemy dwie fazy ciekłe będące wzajemnie nasyconymi roztworami)
dolna temperatura krytyczna – jeżeli istnieje temperatura, poniżej której ciecze stają się całkowicie mieszalne.
Zredukowane stałe krytyczne |
Bardzo często wielkości fizyczne charakteryzujące określony stan materii wyraża się względem parametrów krytycznych, podając tzw. parametry zredukowane (często oznaczane gwiazdką *)[b], na przykład:
- temperatura zredukowana:
- T∗=TTk{displaystyle T^{*}={frac {T}{T_{k}}}}
- gęstość zredukowana:
- ρ∗=ρρk{displaystyle rho ^{*}={frac {rho }{rho _{k}}}}
- ciśnienie zredukowane:
- p∗=ppk{displaystyle p^{*}={frac {p}{p_{k}}}}
- objętość (molowa) zredukowana:
- V∗=VVk{displaystyle V^{*}={frac {V}{V_{k}}}}
Wykorzystywanie wielkości parametrów zredukowanych pozwala łatwo określić „odległość” danego układu od warunków krytycznych i stwierdzić, jakiego rodzaju model fizyczny zjawisk należy stosować.
Temperatury krytyczne niektórych związków chemicznych:
- woda (H2O): 374 °C
- amoniak (NH3): 132,4 °C
- tlen (O2): −118,8 °C
- wodór (H2): −240 °C
Zobacz też |
- punkt krytyczny wody
- stan nadkrytyczny
- zasada stanów odpowiadających sobie
Uwagi |
↑ W wielu źródłach z dziedziny chemii fizycznej symbole funkcji i parametrów stanu odnoszące się do jednego mola są zapisywane wielkimi literami. Symbolem objętości układu zawierającego n moli jest v (v = nV).
↑ Zredukowane parametry p-T-V bywają również oznaczane innymi symbolami, np. π-φ-ϑ, п-ω-τ, pr-Tr-Vr.
Bibliografia |
- Stanisław Bursa: Chemia fizyczna. Wyd. Wyd. 2 popr. Warszawa: PWN, 1979, s. 264–269. ISBN 83-01-00152-6. (pol.)
- Antoni Basiński: Chemia fizyczna. Warszawa: PWN, 1966, s. 319–322.
- Józef Szarawara: Termodynamika chemiczna. Warszawa: WNT, 1979, seria: Inżynieria chemiczna.
- The Equation of State for Gases and Liquids (ang.). W: Nobel Lecture [on-line]. www.nobelprize.org, 12 grudnia 1910. [dostęp 2014-05-12].
- S. Frisz, A. Timoriewa: Kurs fizyki. T. 1, cz. VII. Gazy rzeczywiste. Równanie van der Waalsa, Dokładniejsze obliczenie poprawek…. Warszawa: PWN, 1955, s. 239–257.
- J D van der Waals: Bijdragen tot de kennis van de wet der overeenstemmende toestanden. W: Showing all editions for 'Bijdrage tot de Kennis van de Wet der overeenstemmende toestanden’ [on-line]. www.worldcat.org. [dostęp 2014-05-11].
- T. Hofman: Oddziaływania międzycząsteczkowe i równania stanu (pol.). W: Wykłady z Termodynamiki technicznej i chemicznej, Wydział Chemiczny PW, kierunek: Technologia chemiczna, sem. 2013/2014 [on-line]. www.ch.pw.edu.pl. s. 31. [dostęp 2014-05-11].







